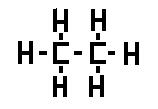jueves, 21 de enero de 2010
...Video sobre Nuestra Carrera...
Aterrizando... ¿Para qué la Ingeniería Química?
La Ingeniería Química desempeña un papel fundamental en el diseño, manutención, evaluación, optimización, simulación, planificación, construcción y operación de plantas en la industria de procesos, que es aquella relacionada con la producción de compuestos y productos cuya elaboración requiere de sofisticadas transformaciones físicas y químicas de la materia.
La ingeniería química también se enfoca al diseño de nuevos materiales y tecnologías, es una forma importante de investigación y de desarrollo. Además es líder en el campo ambiental, ya que contribuye al diseño de procesos ambientalmente amigables y procesos para la descontaminación del medio ambiente. La ingeniería química implica en gran parte el diseño y el mantenimiento de los procesos químicos para la fabricación a gran escala. Emplean a los ingenieros químicos (al igual que los ingenieros de petroleo aunque en menor medida) en esta rama generalmente bajo título de "ingeniero de proceso". El desarrollo de los procesos a gran escala característicos de economías industrializadas es una hazaña de la ingeniería química, no de la química en su más pura expresión. De hecho, los ingenieros químicos son responsables de la disponibilidad de los materiales de alta calidad modernos que son esenciales para hacer funcionar una economía industrial.
Por otro lado, la química es la ciencia que estudia (a escala laboratorio)la materia, sus cambios y la energía involucrada. La importancia radica en que todo lo que nos rodea es materia. El ingeniero químico participa de una manera importante en lo relacionado al diseño y la administración de todo el proceso químico a escala industrial que permite satisfacer una necesidad partiendo de materias primas hasta poner en las manos del consumidor un producto final.
La presencia del profesional de la ingeniería química la podemos ver en áreas tales como la producción, control de procesos, control de calidad, seguridad industrial, apoyo técnico-legal, seguridad e higiene, alimentos, cosmetico y ecología en donde plantea, diseña, construye, opera y controla unidades para disminuir el impacto contaminante de las actividades humanas.
Tareas del Ingeniero Químico
Los Ingenieros Químicos están involucrados en todas las actividades que se relacionen con el procesamiento de materias primas (de origen animal, vegetal o mineral) que tengan como fin obtener productos de mayor valor y utilidad. Por lo tanto, pueden desarrollar sus actividades en:
- Plantas industriales / Empresas Productivas
- Empresas de construcción y/o montaje de plantas y equipos
- Empresas proveedoras de servicios técnicos (consultoría, control de calidad, mantenimiento, etc.)
- Organismos gubernamentales o no gubernamentales de acreditación, control y estándares
- Instituciones de educación superior
- Centros de Investigación y Desarrollo (Industriales / Académicos)
Aplicaciones
Las aplicaciones que puede realizar un Ingeniero Químico son variadas; pueden mencionarse las siguientes a modo de ejemplo:
- Estudios de Factibilidad Técnico-Económica
- Especificación / Diseño de equipos y procesos
- Construcción / Montaje de equipos y plantas
- Control de Producción / Operación de Plantas Industriales
- Gerencia y Administración
- Control de Calidad de Productos
- Compras y Comercialización
- Ventas Técnicas
- Control Ambiental
- Investigación y Desarrollo de Productos y Procesos
- Capacitación de Recursos Humanos
Sectores Industriales
Entre los sectores industriales más importantes que emplean a profesionales de la Ingeniería Química se encuentran:
- Industria Química / Petroquímica
- Gas y Petróleo / Refinerías
- Alimentos y Bebidas / Biotecnología
- Siderúrgica / Metalúrgica / Automotriz
- Materiales / Polímeros / Plásticos
- Generación de energía
- Otras (Farmacéutica, Textil, Papelera, Minera, etc.)
Tema individual en .pdf: Behavioral Targeting
lunes, 18 de enero de 2010
Química Orgánica

También se conoce como química del carbono porque este elemento está presente en todas sus moléculas.
Hay una serie de elementos que forman parte principalmente de estos compuestos: Carbono (C), Hidrógeno (H), Oxígeno (O), Nitrógeno (N).
El carbono (C) tiene 4 electrones en la capa de valencia. Por tanto va a formar siempre 4 enlaces covalentes.
Los enlaces pueden ser: simples, dobles y triples.
El carbono puede unirse con otros carbonos formando de esta manera cadenas de compuestos carbonados.
El hidrógeno solo tiene un electrón formando un enlace covalente simple.
Los compuestos orgánicos se representan mediante una fórmula que puede ser empírica, molecular y estructural.Empírica: Con/En la empírica se expresa la proporción en la que están los distintos elementos.
Molecular: Indica el número de átomos totales del compuesto.
Estructural: Indica todos los enlaces que existen en la molécula.
Como la fórmula estructural es muy larga se suele escribir de una manera más simplificada.CH3-CH=CH-CH3
Isomería: Dos compuestos orgánicos son isómeros si tienen la misma forma molecular y distinta fórmula estructural. Esto implica que sus propiedades van a ser diferentes.
Hidrocarburos: Son compuestos orgánicos formados solamente por carbono e hidrógeno.
Podemos clasificarlos en: Alcanos, Alquenos y Alquinos.Alcanos: En ellos todos los enlaces Carbono-Carbono (C-C) son simples.
Alquenos: En ellos hay al menos un enlace doble.
Alquinos: En ellos hay al menos un enlace triple.
Alcanos
Nomenclatura de los Alcanos:
- Se cuenta el número de Carbonos de la cadena y se le asigna una raíz en función del número de estos.
1 Carbono: met-
2 Carbono: et-
3 Carbono: prop-
4 Carbono: but-
5 Carbono: pent-
...
- Se le añade el sufijo -ano
- Si existen cadenas ramificadas, utilizamos los siguientes criterios:
a) tomamos como cadena principal a la que mayor número de carbonos tenga
b) asignamos a cada átomo de "C" de la cadena un número localizador.
b) comenzamos a contar por el extremo que tenga más próxima la rama.
d) se nombran anteponiendo el localizador al nombre del hidrocarburo.
e) los nombres de los sustituyentes añadiendo al nombre de la raíz el sufijo -il o -ilo.
- Si aparecen más de un radical (o más de un sustiyente), hemos de nombrar a todos por orden alfabético. Si se repite alguno se le añade el prefijo di-.
Propiedades físicas y químicas de los alcanos
Propiedades físicas
Puntos de ebullición suelen ser bajos y crecen al aumentar la longitud de la cadena. Esto explica que el propano sea gas y el hexano líquido. Los alcanos son insolubles y son gases a temperatura ambiente de bajo peso molecular.
Propiedades Químicas
Los alcanos reaccionan muy poco. La combustión puede ser completa o incompleta.
La combustión es completa cuando el oxígeno es abundante.
La combustión es incompleta cuando el oxígeno es escaso.
Peligros de la combustión Incompleta
- El CO es tóxico.
- Reacciona con la emoglobina de la sangre impidiendo que esta sea transportada con oxígeno a la sangre.
- Puede dar lugar a partículas de carbon no quemadas (este hollín que se deposita en las chimeneas y a la larga puede provocar incendios).
Peligros de la combustión completa
- La combustión completa produce dióxido de carbono (CO2). Este gas ocasiona junto a otros como el metano el efecto invernadero. Este efecto, mantiene la temperatura de la tierra pues impide que salgan las radiaciones infrarojas del suelo.
Actualmente debido al aumento de las combustiones estña aumentando la concentración de CO2 en la atmósfera.Fuentes de hidrocarburos
- El petróleo: Se obtiene los distintos hidrocarburospor destilación. Al llegar a una refinería se somete al petróleo a una destilación fraccionada, separándolo en distintas fracciones en función de su punto de ebullición. Puede suceder que las cantidades obtenidas de alguna fracción sean insuficientes por lo tanto procede a realizar nuevos procesos, entre ellos está el craqueo (cracking). El craqueo consiste en romper cadenas largas, obteniendo otras mñas pequeñas que sean más útiles. Suele realizarse por medio de calor o en presencia de catalizadores.
- Gas Natural: Es también un combustible fósil que esta formadoprincipalmentepor metano (CH4). Se emplea fundamentalmente para la producción de energía porque es un gas que contamina menos que el carbón pero que también contribuye al aumento de la concentración de CO2. Este metano también puede obtenerse de la descomposición de la materia viva.
Alquenos
Los alquenos son hidrocarburos que tienen un doble enlace carbono=carbono (C=C) en su estructura.
Nomenclatura de los Alquenos:
- La cadena principal es la que tiene mayor número de dobles enlaces.
- Se empiezan a contar los localizadores de forma que el número que asignemos al enlace sea el menor.
- Se nombran igual que los alcanos sustituyendo el sufijo -ano por -eno indicando el localizador del doble enlace.
Propiedades físicas y químicas de los alquenos
Propiedades físicas
Son similares a las de los alcanos
Propiedades químicas
Debido a la presencia del doble enlace estos compuestos son mucho más reactivos que los alcanos. Entre las reacciones más características, se encuentran:
- La adición al doble enlace. Se le añade una molécula rompiendo el doble enlace.
- Polimerización. Los alquenos pueden polimerizarse fácilmente, para ello al calentarlos y en presencia de catalizadores se rompe el doble enlaceformando unas especies químicas inestables. Estas especies químicas se unen entre sí, formando largas cadenas que son los polimeros.
domingo, 17 de enero de 2010
La Famosa Tabla Periódica: ¿Por qué creer en ella?

La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características.
Suele atribuirse la tabla a Dimitri Mendeleiev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos.
La historia de la tabla periódica está íntimamente relacionada con varios aspectos del desarrollo de la química y la física:
El descubrimiento de los elementos de la tabla periódica
El estudio de las propiedades comunes y la clasificación de los elementos
La noción de masa atómica (inicialmente denominada "peso atómico") y, posteriormente, ya en el siglo XX, de número atómico y
Las relaciones entre la masa atómica (y, más adelante, el número atómico) y las propiedades periódicas de los elementos.
El descubrimiento de los elementos
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y el mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo XVIII se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino-térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.
La noción de elemento y las propiedades periódicas
Lógicamente, un requisito previo necesario a la construcción de la tabla periódica era el descubrimiento de un número suficiente de elementos individuales, que hiciera posible encontrar alguna pauta en comportamiento químico y sus propiedades. Durante los siguientes 2 siglos, se fue adquiriendo un gran conocimiento sobre estas propiedades, así como descubriendo muchos nuevos elementos.
La palabra "elemento" procede de la ciencia griega pero su noción moderna apareció a lo largo del siglo XVII, aunque no existe un consenso claro respecto al proceso que condujo a su consolidación y uso generalizado. Algunos autores citan como precedente la frase de Robert Boyle en su famosa obra "The Sceptical Chymist", donde denomina elementos "ciertos cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos de otros, y que son los ingredientes de que se componen inmediatamente y en que se resuelven en último término todos los cuerpos perfectamente mixtos". En realidad, esa frase aparece en el contexto de la crítica de Robert Boyle a los cuatro elementos aristotélicos.
A lo largo del siglo XVIII, las tablas de afinidad recogieron un nuevo modo de entender la composición química, que aparece claramente expuesto por Lavoisier en su obra "Tratado elemental de Química". Todo ello condujo a diferenciar en primer lugar qué sustancias de las conocidas hasta ese momento eran elementos químicos, cuáles eran sus propiedades y cómo aislarlos.
El descubrimiento de un gran número de nuevos elementos, así como el estudio de sus propiedades, pusieron de manifiesto algunas semejanzas entre ellos, lo que aumentó el interés de los químicos por buscar algún tipo de clasificación.
Los pesos atómicos
A principios del siglo XIX, John Dalton (1766-1844) desarrolló una nueva concepción del atomismo, al que llegó gracias a sus estudios meteorológicos y de los gases de la atmósfera. Su principal aportación consistió en la formulación de un "atomismo químico" que permitía integrar la nueva definición de elemento realizada por Antoine Lavoisier (1743-1794) y las leyes ponderales de la química (proporciones definidas, proporciones múltiples, proporciones recíprocas).
Dalton empleó los conocimientos sobre proporciones en las que reaccionaban las sustancias de su época y realizó algunas suposiciones sobre el modo cómo se combinaban los átomos de las mismas. Estableció como unidad de referencia la masa de un átomo de hidrógeno (aunque se sugirieron otros en esos años) y refirió el resto de los valores a esta unidad, por lo que pudo construir un sistema de masas atómicas relativas. Por ejemplo, en el caso del oxígeno, Dalton partió de la suposición de que el agua era un compuesto binario, formado por un átomo de hidrógeno y otro de oxígeno. No tenía ningún modo de comprobar este punto, por lo que tuvo que aceptar esta posibilidad como una hipótesis a priori.
Dalton conocía que 1 parte de hidrógeno se combinaba con 7 partes (8 afirmaríamos en la actualidad) de oxígeno para producir agua. Por lo tanto, si la combinación se producía átomo a átomo, es decir, un átomo de hidrógeno se combinaba con un átomo de wolframio, la relación entre las masas de estos átomos debía ser 1:7 (o 1:8 se calcularía en la actualidad). El resultado fue la primera tabla de masas atómicas relativas (o pesos atómicos como los llamaba Dalton) que fue posteriormente modificada y desarrollada en los años posteriores. Las incertidumbres antes mencionadas dieron lugar a toda una serie de polémicas y disparidades respecto a las fórmulas y los pesos atómicos que sólo comenzarían a superarse, aunque no totalmente, con el congreso de Karlsruhe en 1860.
Metales, no metales y metaloides y metales de transición
La primera clasificación de elementos conocida fue propuesta por Antoine Lavoisier, quien propuso que los elementos se clasificaran en metales, no metales y metaloides o metales de transición. Aunque muy práctico y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias en las propiedades físicas como químicas.
Compuestos Químicos

Son un extenso grupo de compuestos binarios que resultan de la unión de un metal o no metal con el oxigeno. Se clasifican en óxidos básicos u óxidos metálicos y óxidos ácidos u no metálicos.
Óxidos Metálicos:
Son compuestos con elevado punto de fusión que se forman como consecuencia de la reacción de un metal con él oxigeno. Esta reacción es la que produce la corrosión de los metales al estar expuesto al oxigeno del aire.
Un ejemplo de formación de un óxido metálico es la reacción del magnesio con él oxigeno, la cual ocurre con mayor rapidez cuando se quema una cinta de magnesio. La cinta de magnesio de color grisáceo se torna en un polvo blanco que es el óxido de magnesio. Ecuación:
Magnesio + Oxigeno Óxido de Magnesio
2mg + O2 2mgO
Los Óxidos Metálicos se denominan también Óxidos Básicos por que tiene la propiedad de reaccionar con el agua y formar bases o hidróxidos.
Ejemplo: Óxido de Magnesio + Agua Hidróxido de Magnesio
mgO + H2O mg (OH)2
Las bases se pueden reconocer fácilmente a través de un cambio de color en un indicador acido-básico como el papel tornasol. Las disoluciones básicas tornan el papel tornasol rosado a un color azul al entrar en contacto con ella.
Óxidos No Metálicos u Ácidos:
Los óxidos no metálicos son compuestos de bajos puntos de fusión que se forman al reaccionar un no metal con el oxigeno. Se denominan también anhídridos y muchos de ellos son gaseosos.
Ejemplo: Carbono + Oxigeno Dióxido de Carbono.
C + O2 CO2
Cuando los óxidos metálicos reaccionan con el agua forman ácidos, por lo que se le llaman también óxidos ácidos.
Ejemplo: Dióxido de Carbono + Agua Acido Carbónico
CO2 + H2O H2CO3
Los Ácidos se pueden también reconocer por el cambio de color de un indicador ácido-base como el papel tornasol. Las disoluciones ácidas tornan el papel tornasol azul a un color rosado al entrar en contacto con ella.
Los ácidos producidos por la reacción de los óxidos no metálicos con el agua se denominan Oxácidos debido a que contienen Oxigeno.
Ácidos
Los ácidos y las bases son grupos de compuestos que pueden ser identificados por su acción frente a los indicadores.
Los hidrácidos y los oxácidos se forman de la siguiente manera:
• Al reaccionar un no metal con el hidrogeno se forma un hidrácido.
Ejemplo: Cloro + Hidrogeno Acido Clorhídrico
Cl2 + H2 2HCl
• Al reaccionar un óxido ácido con agua se forma un oxácido.
Ejemplo: Trióxido de Azufre + Agua Acido Sulfúrico.
SO3 + H2O H2SO4.
Propiedades de Los Ácidos:
1. Tienen sabor ácido como en el caso del ácido cítrico en la naranja.
2. Cambian el color del papel tornasol azul a rosado, el anaranjado de metilo de anaranjado a rojo y deja incolora a la fenolftaleina.
3. Son corrosivos.
4. Producen quemaduras de la piel.
5. Son buenos conductores de electricidad en disoluciones acuosas.
6. Reaccionan con metales activos formando una sal e hidrogeno.
7. Reacciona con bases para formar una sal mas agua.
8. Reaccionan con óxidos metálicos para formar una sal mas agua.
Bases
Son compuestos que resultan de la unión de un oxido básico con el agua, y se forman de dos maneras:
1. Ejemplo: Litio + agua Hidróxido de Litio
2Li + 2H2O 2LiOH + H2.
2. Al reaccionar en metal activo con agua.
3. Al reaccionar un óxido básico con agua.
Ejemplo: Óxido de Sodio + Agua Hidróxido de Sodio
2NaO + 2H2O 2NaOH + H2.
Propiedades de las Bases:
1. Tienen sabor amargo.
2. Cambian el papel tornasol de rosado a azul, el anaranjado de metilo de anaranjado a amarillo y la fenolftaleina de incolora a rosada fucsia.
3. Son jabonosas al tacto.
4. Son buenas conductoras de electricidad en disoluciones acuosas.
5. Son corrosivos.
6. Reaccionan con los ácidos formando una sal y agua.
7. Reacciona con los óxidos no metálicos para formar sal y agua.
Sales
Son compuestos que resultan de la reacción de un acido con una base.
Formulación y nomenclatura:
Una sal haloidea, es decir, una sal que no contiene oxígeno se puede formar a través de reacciones como las siguientes:
1. Ejemplo: Potasio + Cloro Cloruro de potasio
2 k + Cl2 2HCl
2. Al reaccionar un metal con un halógeno.
Ejemplo: Magnesio + Ácido clorhídrico Cloruro de Magnesio
Mg + 2 HCl MgCl2 + H2
3. Al reaccionar un metal activo con un hidrácido.
Ejemplo: Ácido bromhídrico + Óxido metálico Bromuro de + agua
Sodio
2HBr + 2NaO 2 NaBr + H2O
4. Al reaccionar un hidrácido con un óxido metálico.
Ejemplo: Ácido clorhídrico + Hidróxido de sodio Cloruro de sodio + Agua
HCl + NaOH NaCl + H2O
Una oxisal, es decir, una sal que contiene oxígeno se puede formar así:
5. Al reaccionar un hidrácido y un hidróxido (neutralización)
Ejemplo: Magnesio + Ácido sulfúrico Sulfato de magnesio
+ Hidrógeno
Mg + H2SO4 MgSO4 + H2O
6. Al reaccionar un metal activo con un oxácido.
Ejemplo: Hidróxido de calcio + Dióxido de carbono Carbonato de
Calcio + agua
Ca(OH)2 + CO2 CaCO3 + H2O
7. Al reaccionar un hidróxido con un anhídrido.
8. Al reaccionar un hidróxido y un oxácido (neutralización)
Ejemplo: Ácido nítrico + hidróxido de bario Nitrato de
Bario + agua
2HNO3 + Ba(OH)2 Ba(NO3)2 + 2H2O
lunes, 11 de enero de 2010
Introducción: Átomos, Moléculas y Compuestos
Antes de entrar en materia, es nuestro deseo darle la bienvenida a todos los estudiantes que consultan este blog creado por los estudiantes de Ing. Quimica de INTEC.
Para el estudio de la química es fundamental conocer las estructura de la materia. En lo que concierne a la química esta se divide en: átomos, moléculas y compuestos. El átomo es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos. Un ejemplo de un átomo es el átomo de oxígeno cuyo símbolo es O. La molécula constituye la mínima cantidad de una sustancia que mantiene todas sus propiedades químicas un ejemplo es el O2. Un compuesto es una sustancia formada por la unión de dos o más elementos de la tabla periódica, en una razón fija el compuesto más abundante en la naturaleza es el agua, cuya fórmula es H2O.